
公司新聞
COMPANY NEWS
丁苯酞靶向小分子代謝:空間代謝組學新證據
發布時間:2025-02-18|
作者:石藥集團
近日,北京大學第一醫院黃一寧/金海強/鄧健文/王朝霞教授團隊的最新研究成果《Spatial metabolic analysis of the regulatory effects of DL-3-n-butylphthalide in a cerebral ischemia-reperfusion mouse model》發表于《Neurotherapeutics》雜志上(IF=5.6),博士生盧宇軒為第一作者。本研究旨在利用空間代謝組學分析NBP在腦缺血再灌注過程中引起的代謝變化。研究結果顯示NBP可以通過調節檸檬酸循環、丙酮酸代謝、自噬和不飽和脂肪酸生物合成的途徑,顯著減少腦缺血面積并改善神經功能。進一步的研究證實,NBP可顯著改善線粒體形態、自噬和鐵死亡等相關指標。這些發現為闡明NBP在治療腦缺血再灌注損傷中的作用機制提供了更多的依據。
卒中是全球最常見的死亡和殘疾原因之一,其中缺血性卒中(IS)占87%,對患者造成重大損害。目前急性期IS的治療主要包括機械取栓、溶栓和抗血栓治療,主要側重于血栓清除和血管再通。越來越多的研究表明,缺血再灌注損傷在IS的進展和預后中起著重要作用,這表明神經保護治療可能是一種有前景的治療方法。因此,更多的研究正致力于開發旨在減少缺血再灌注損傷的腦卒中保護療法。
DL-3-正丁基苯酞(NBP)是一種從芹菜籽中提取的有效成分,已被證明在治療IS方面具有良好的臨床療效和安全性。前期研究表明,NBP在腦缺血再灌注過程中改善了線粒體功能。其他研究也闡釋其潛在機制包括減少神經血管炎癥、促進血管生成、抑制凋亡和自噬。然而,NBP對于腦缺血再灌注損傷中小分子代謝物空間分布影響的系統研究尚不多見。
目前,腦組織代謝物的分析技術包括液相色譜-質譜法(LC-MS)和氣相色譜-質譜聯用法(GC-MS)。然而,這些技術在反映代謝物的空間信息方面缺乏特異性,而這種特異性對于準確理解復雜的生理和病理過程至關重要。空間代謝組學(SM)因其提供三維組學數據的能力而受到了廣泛的關注。經過相關技術的多次迭代,開發了新一代氣流輔助解吸電噴霧電離質譜成像(AFADESI-MSI)。因其不需要基質輔助或高真空環境,從而提供了更好的靈敏度和檢測范圍,目前已用于藥物的作用機制研究。
本研究旨在使用AFADESI-MSI研究NBP對小分子代謝物空間變化的影響,以預測其對缺血再灌注損傷的潛在保護機制。
研究方法
體內實驗中,通過閉塞大腦中動脈1小時后再灌注,構建小鼠腦缺血再灌注模型。再灌注的同時靜脈注射NBP或生理鹽水,24小時后評估包括神經系統評分和代謝物改變在內的藥效指標。體外實驗中,運用HT22小鼠神經元細胞系構建缺氧復氧細胞模型評估NBP的療效,具體如圖1所示。
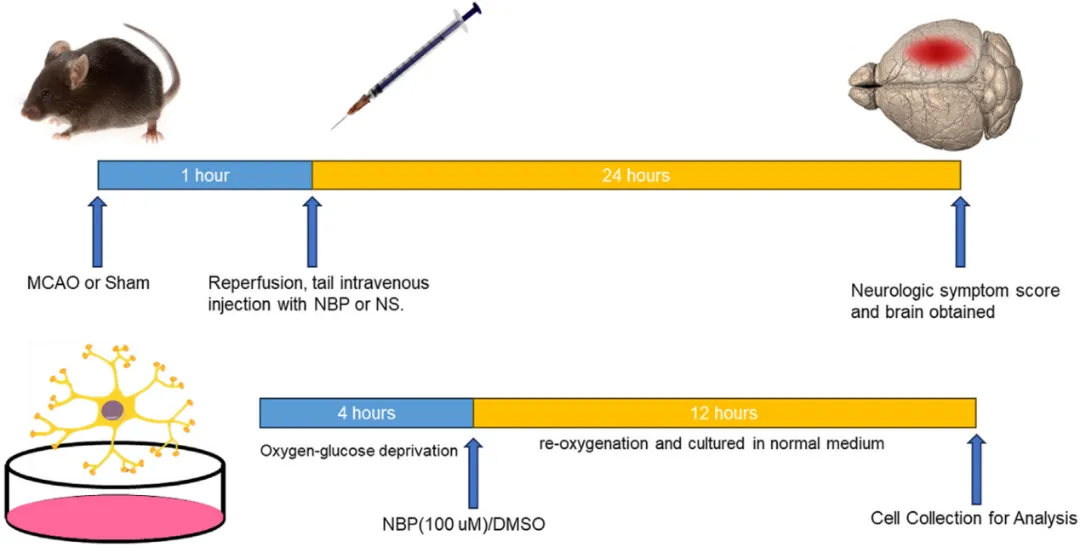
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 圖1. 實驗流程圖
研究結果
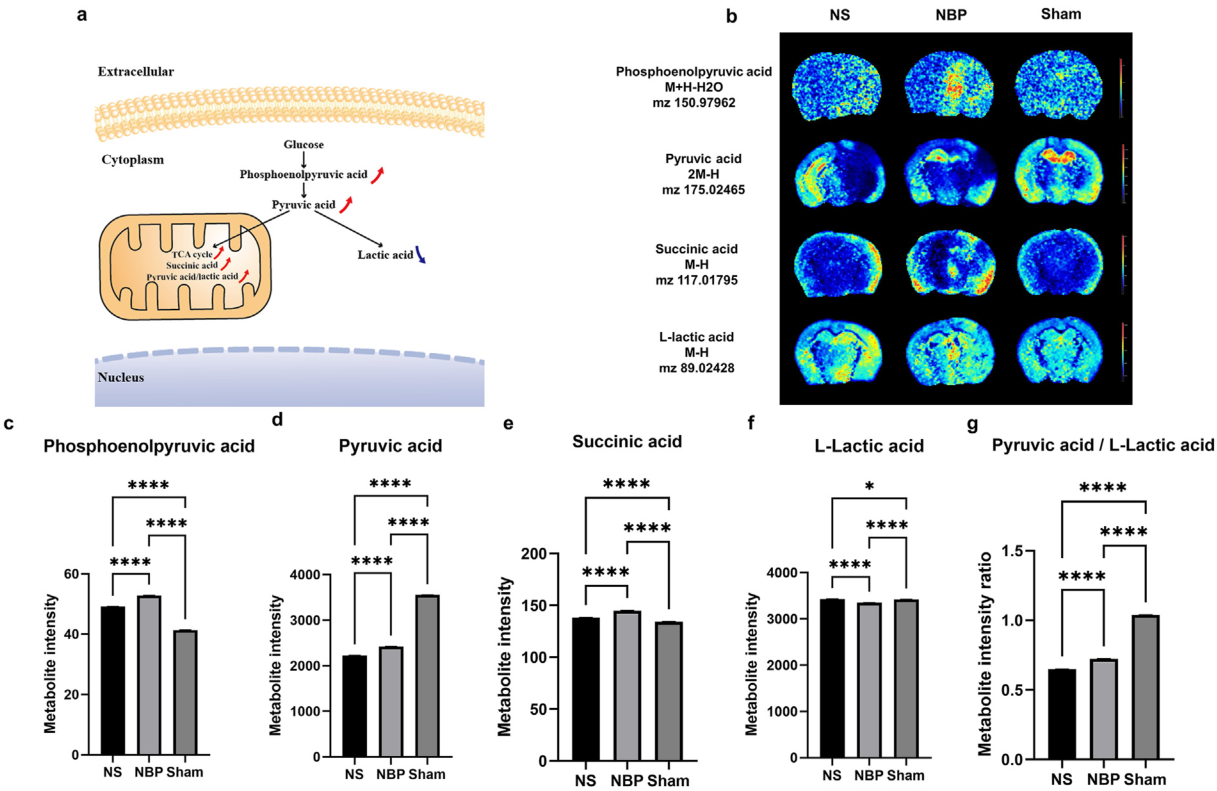
大腦極易發生局部缺血,盡管只占其體重的2%,但消耗了人體約20-25%的氧氣和葡萄糖。不間斷的能量供應對腦組織功能至關重要,外源性(如氧氣和葡萄糖)或內源性(如線粒體功能障礙)因素造成的中斷均可能導致不可逆的損傷。KEGG通路富集分析表明,NBP上調了與丙酮酸代謝和檸檬酸循環相關的通路,這兩者都是能量供應所必需的(圖3i)。圖4a顯示了詳細的能量供應機制的示意圖。NBP組能量相關代謝物的水平,包括磷酸烯醇丙酮酸、丙酮酸和琥珀酸,顯著上調,而乳酸水平顯著下調(圖4b-f)。這些發現表明NBP組的線粒體有氧呼吸能量供應系統顯著增強。此外,丙酮酸與L-乳酸比例的增加(圖4g)同樣表明NBP組的線粒體功能增強,綜上結果顯示線粒體是NBP的潛在靶點。
(四)NBP改善線粒體形態
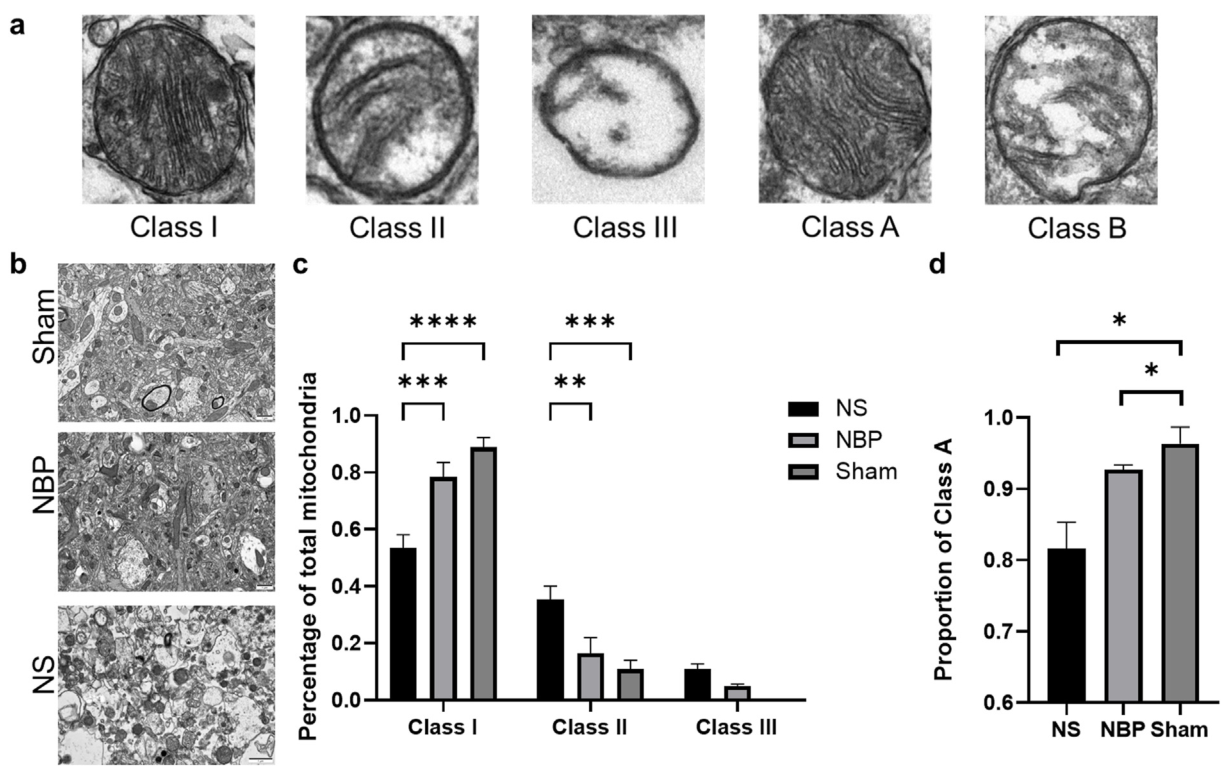
空間代謝組學的結果表明線粒體可能是NBP的靶點。為了進一步驗證這一假設,研究人員分析了線粒體的形態變化,包括線粒體嵴數、基質密度和腫脹。從形態學的角度來看,每個線粒體的嵴數量增加和基質密度增加表明線粒體功能狀態得到改善。線粒體嵴、基質密度和腫脹的分類如圖5a所示。分析結果顯示,NBP對于線粒體嵴、基質密度和腫脹表現出不同程度的改善作用(圖5b, c和d)。
(五)NBP抑制自噬
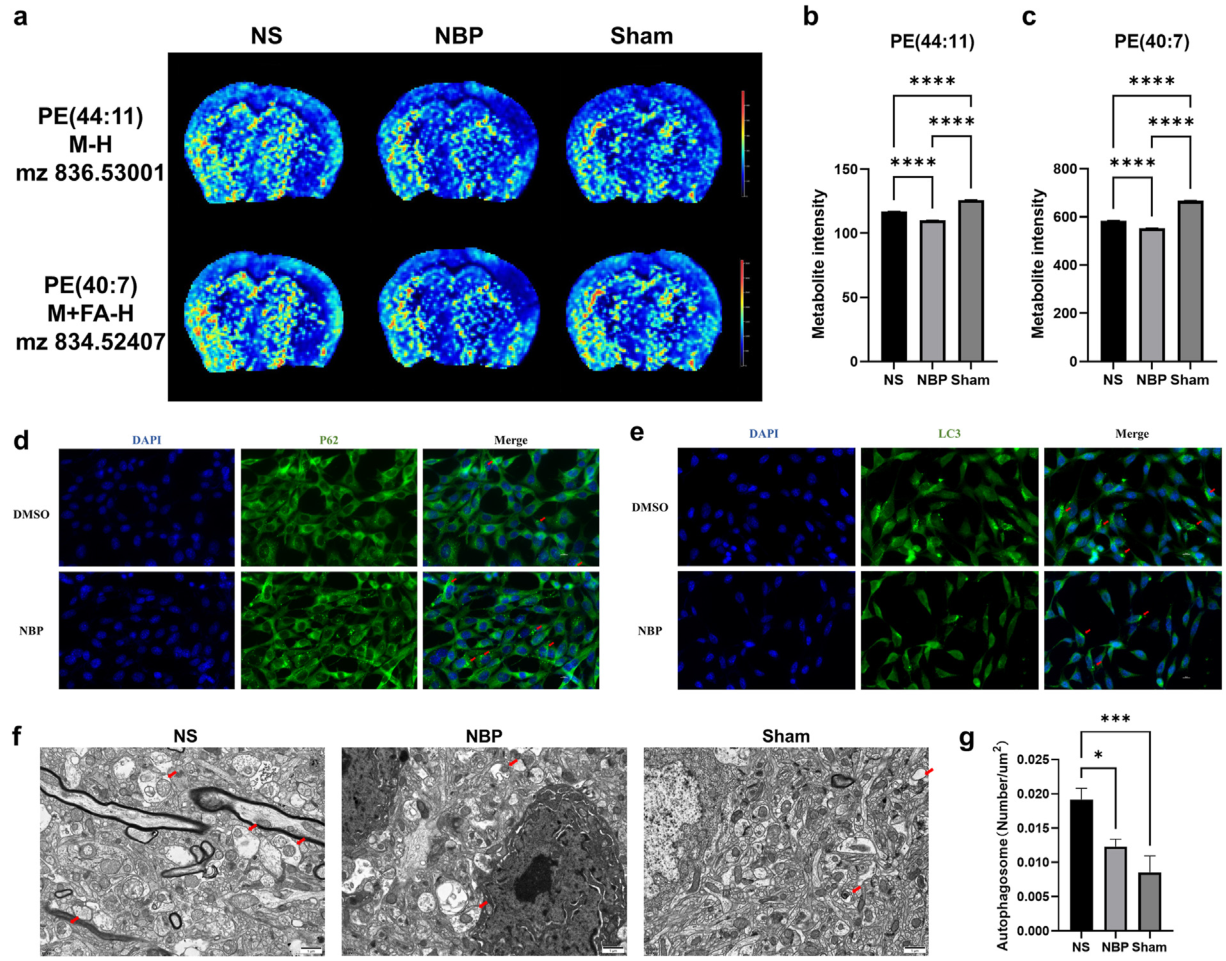
自噬是一種細胞機制,可以隔離受損/老化的細胞器、多余的蛋白質和細胞成分,因其在多種疾病中的潛在致病作用而受到廣泛關注。有研究表明磷脂酰乙醇胺(PE)是自噬的關鍵調節因子。在該研究中,代謝物分析顯示了自噬途徑的顯著下調,如PE水平降低所示(圖3j和6a),并通過定量分析驗證了這些發現(圖6b和c),表明抑制自噬可能是NBP的作用機制之一。在缺氧復氧細胞模型中,NBP組細胞的LC3表達降低,p62表達升高,表明NBP對于細胞自噬具有潛在的抑制作用(圖6d和e)。此外,透射電子顯微鏡(TEM)的結果也顯示了NBP處理后的神經元細胞中的自噬體的減少(圖6f和g)。綜上所述,這些結果表明NBP可能通過抑制細胞自噬發揮神經保護作用。
(六)NBP減少不飽和脂肪酸的生物合成
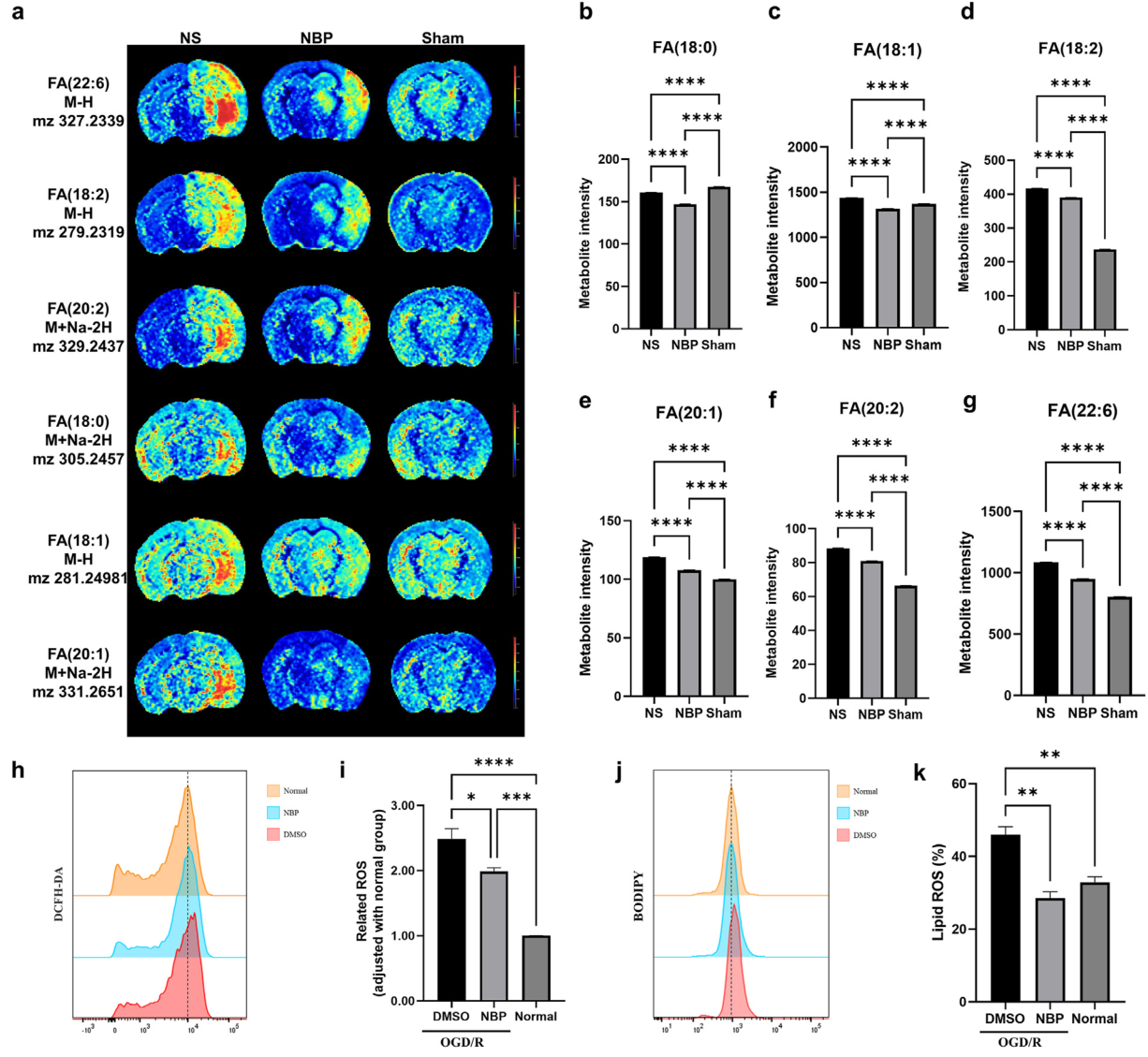
脂質代謝在維持正常細胞功能方面至關重要,有研究表明,多不飽和脂肪酸(PUFA)參與調節鐵死亡,鐵死亡是一種參與缺血再灌注損傷的細胞死亡方式。研究結果顯示,NBP可以抑制不飽和脂肪酸的生物合成途徑(圖3j),通過定量分析也證實了NBP參與到PUFA的生物合成途徑中(圖7a-g),表明鐵死亡可能是NBP改善神經功能的潛在機制之一。此外,ROS作為鐵死亡的重要指標,在細胞模型中,NBP也表現出降低ROS(圖7h和i)和脂質ROS(圖7j和k)的作用。綜上結果表明,NBP可能通過抑制不飽和脂肪酸的生物合成來抑制鐵死亡,從而發揮神經保護作用。
(七)NBP改善腦缺血再灌注損傷的機制圖
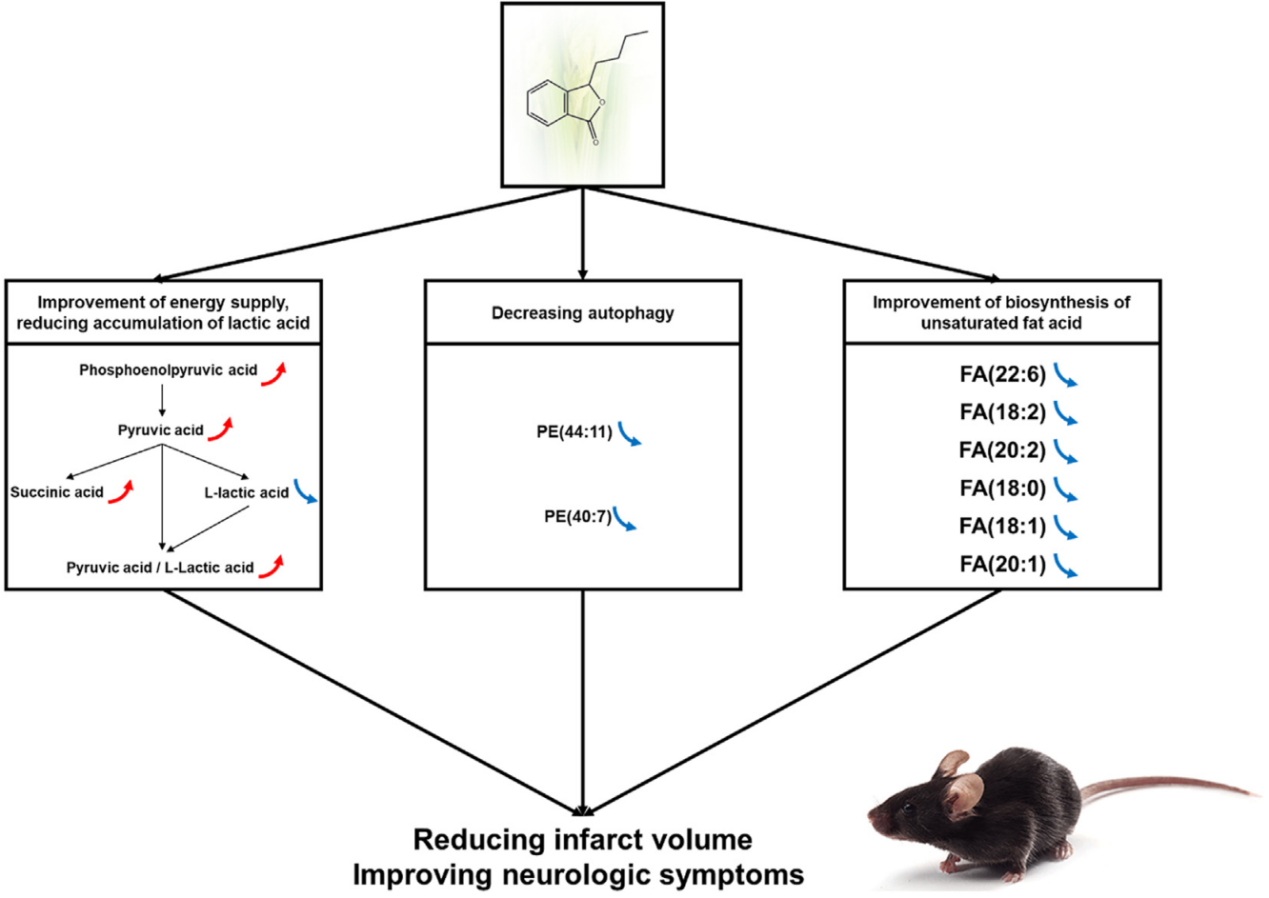
NBP通過調節小分子代謝途徑發揮對MCAO小鼠腦缺血再灌注損傷的治療作用。潛在的作用機制包括增強能量供應、減少乳酸積累、抑制自噬和改善不飽和脂肪酸的生物合成,如圖8所示。
研究結論
本研究表明,NBP通過改善能量供應、減少乳酸積累、減輕自噬和抑制多不飽和脂肪酸(PUFA)生物合成發揮神經保護的作用。此外,NBP對于線粒體形態和鐵死亡的相關指標均具有改善作用。這些發現為NBP治療腦缺血再灌注損傷后小分子代謝物改變的精確空間分布提供了新的見解。
(一)NBP對缺血再灌注過程中的神經功能具有保護作用
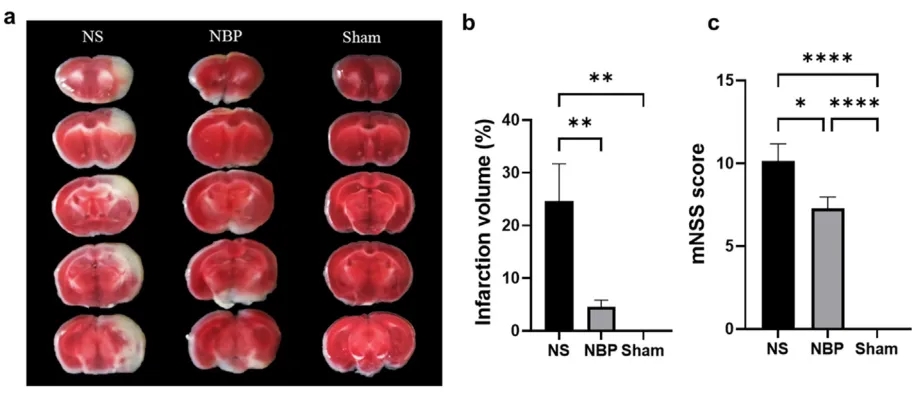
TTC染色顯示,與生理鹽水(NS)組相比,NBP治療組的梗死面積顯著減少(圖2a和b)。此外,NBP組也表現出較輕的神經功能缺損癥狀(圖2c)。這些結果表明,NBP對腦缺血再灌注損傷模型的神經功能具有良好的保護作用。
(二)使用AFADESI-MSI鑒定NBP神經保護作用的潛在機制
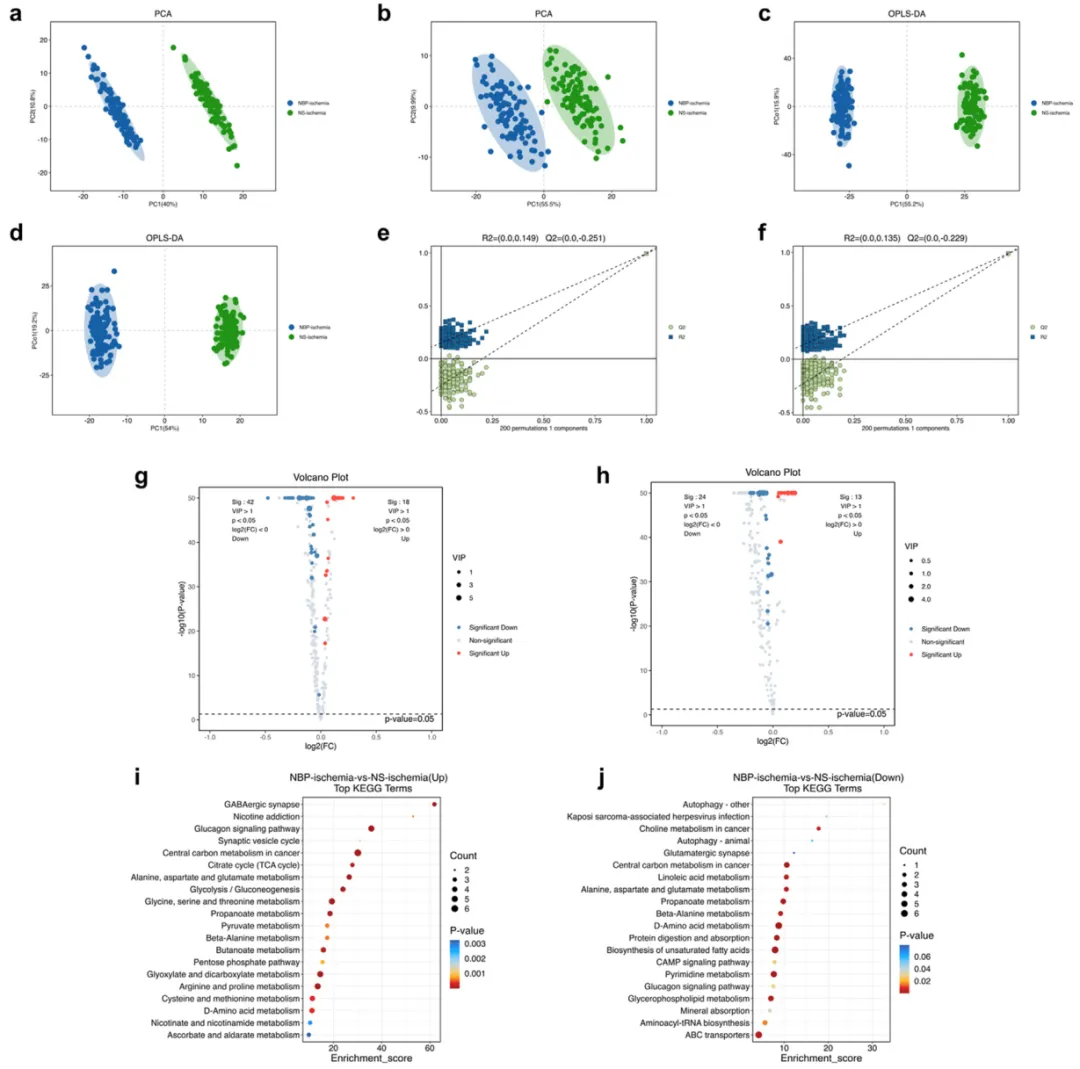
運用空間代謝組學(SM)研究NBP對代謝物譜的影響。主成分分析(PCA)揭示了兩組之間不同的代謝物模式(圖3a和b),正交偏最小二乘法判別分析(OPLS-DA)顯示了聚類和分組差異(圖3c和d)。置換測試通過7倍交叉驗證和200個響應來評估模型的質量,表明兩組結果沒有過擬合(圖3e和f)。在負電離模式下鑒定出481種代謝物,在正電離模式下鑒別出295種代謝物。在負離子模式下,有18種上調的代謝物和42種下調的代謝物,在正離子模式下有13種上調的代謝產物和24種下調的代謝產物(圖3g和h)。隨后的分類和通路富集分析揭示了NBP影響的關鍵代謝通路(圖3i和j)。
TTC染色顯示,與生理鹽水(NS)組相比,NBP治療組的梗死面積顯著減少(圖2a和b)。此外,NBP組也表現出較輕的神經功能缺損癥狀(圖2c)。這些結果表明,NBP對腦缺血再灌注損傷模型的神經功能具有良好的保護作用。

圖2. NBP對梗死面積和神經功能缺損癥狀的影響
(二)使用AFADESI-MSI鑒定NBP神經保護作用的潛在機制
運用空間代謝組學(SM)研究NBP對代謝物譜的影響。主成分分析(PCA)揭示了兩組之間不同的代謝物模式(圖3a和b),正交偏最小二乘法判別分析(OPLS-DA)顯示了聚類和分組差異(圖3c和d)。置換測試通過7倍交叉驗證和200個響應來評估模型的質量,表明兩組結果沒有過擬合(圖3e和f)。在負電離模式下鑒定出481種代謝物,在正電離模式下鑒別出295種代謝物。在負離子模式下,有18種上調的代謝物和42種下調的代謝物,在正離子模式下有13種上調的代謝產物和24種下調的代謝產物(圖3g和h)。隨后的分類和通路富集分析揭示了NBP影響的關鍵代謝通路(圖3i和j)。

圖3. AFADESI-MSI鑒定NBP神經保護作用的潛在機制
(三)NBP改善能量供應并減少乳酸積累大腦極易發生局部缺血,盡管只占其體重的2%,但消耗了人體約20-25%的氧氣和葡萄糖。不間斷的能量供應對腦組織功能至關重要,外源性(如氧氣和葡萄糖)或內源性(如線粒體功能障礙)因素造成的中斷均可能導致不可逆的損傷。KEGG通路富集分析表明,NBP上調了與丙酮酸代謝和檸檬酸循環相關的通路,這兩者都是能量供應所必需的(圖3i)。圖4a顯示了詳細的能量供應機制的示意圖。NBP組能量相關代謝物的水平,包括磷酸烯醇丙酮酸、丙酮酸和琥珀酸,顯著上調,而乳酸水平顯著下調(圖4b-f)。這些發現表明NBP組的線粒體有氧呼吸能量供應系統顯著增強。此外,丙酮酸與L-乳酸比例的增加(圖4g)同樣表明NBP組的線粒體功能增強,綜上結果顯示線粒體是NBP的潛在靶點。

圖4. NBP增強能量供應和減少乳酸積累
(四)NBP改善線粒體形態
空間代謝組學的結果表明線粒體可能是NBP的靶點。為了進一步驗證這一假設,研究人員分析了線粒體的形態變化,包括線粒體嵴數、基質密度和腫脹。從形態學的角度來看,每個線粒體的嵴數量增加和基質密度增加表明線粒體功能狀態得到改善。線粒體嵴、基質密度和腫脹的分類如圖5a所示。分析結果顯示,NBP對于線粒體嵴、基質密度和腫脹表現出不同程度的改善作用(圖5b, c和d)。

圖5. NBP改善線粒體形態
(五)NBP抑制自噬
自噬是一種細胞機制,可以隔離受損/老化的細胞器、多余的蛋白質和細胞成分,因其在多種疾病中的潛在致病作用而受到廣泛關注。有研究表明磷脂酰乙醇胺(PE)是自噬的關鍵調節因子。在該研究中,代謝物分析顯示了自噬途徑的顯著下調,如PE水平降低所示(圖3j和6a),并通過定量分析驗證了這些發現(圖6b和c),表明抑制自噬可能是NBP的作用機制之一。在缺氧復氧細胞模型中,NBP組細胞的LC3表達降低,p62表達升高,表明NBP對于細胞自噬具有潛在的抑制作用(圖6d和e)。此外,透射電子顯微鏡(TEM)的結果也顯示了NBP處理后的神經元細胞中的自噬體的減少(圖6f和g)。綜上所述,這些結果表明NBP可能通過抑制細胞自噬發揮神經保護作用。

圖6. NBP對自噬的抑制作用
(六)NBP減少不飽和脂肪酸的生物合成
脂質代謝在維持正常細胞功能方面至關重要,有研究表明,多不飽和脂肪酸(PUFA)參與調節鐵死亡,鐵死亡是一種參與缺血再灌注損傷的細胞死亡方式。研究結果顯示,NBP可以抑制不飽和脂肪酸的生物合成途徑(圖3j),通過定量分析也證實了NBP參與到PUFA的生物合成途徑中(圖7a-g),表明鐵死亡可能是NBP改善神經功能的潛在機制之一。此外,ROS作為鐵死亡的重要指標,在細胞模型中,NBP也表現出降低ROS(圖7h和i)和脂質ROS(圖7j和k)的作用。綜上結果表明,NBP可能通過抑制不飽和脂肪酸的生物合成來抑制鐵死亡,從而發揮神經保護作用。

圖7. NBP抑制不飽和脂肪酸生物合成
(七)NBP改善腦缺血再灌注損傷的機制圖
NBP通過調節小分子代謝途徑發揮對MCAO小鼠腦缺血再灌注損傷的治療作用。潛在的作用機制包括增強能量供應、減少乳酸積累、抑制自噬和改善不飽和脂肪酸的生物合成,如圖8所示。

圖8. NBP改善腦缺血再灌注損傷的機制圖
研究結論
本研究表明,NBP通過改善能量供應、減少乳酸積累、減輕自噬和抑制多不飽和脂肪酸(PUFA)生物合成發揮神經保護的作用。此外,NBP對于線粒體形態和鐵死亡的相關指標均具有改善作用。這些發現為NBP治療腦缺血再灌注損傷后小分子代謝物改變的精確空間分布提供了新的見解。






